Правило Марковникова — один із найважливіших інструментів органічної хімії, який допомагає школярам і студентам правильно прогнозувати продукти реакцій приєднання до алкенів. Воно було сформульоване російським хіміком Володимиром Марковниковим ще у 1869 році, але й досі залишається актуальним у 10 класі та на перших курсах університетів. Розберемо його максимально просто й зрозуміло.
Формулювання правила Марковникова
Правило Марковникова стосується реакцій електрофільного приєднання (найчастіше це гідрогалогенування HX, гідратація, гідроборування в окремих випадках) до несиметричних алкенів.
Правило Марковникова українською звучить так:
при приєднанні полярної молекули HX (де X — галоген, OH, тощо) до несиметричного алкену водень приєднується до того атома вуглецю при подвійному зв’язку, який уже має більше атомів водню, а галоген (або інша негативна частина) — до вуглецю, який має менше воднів.
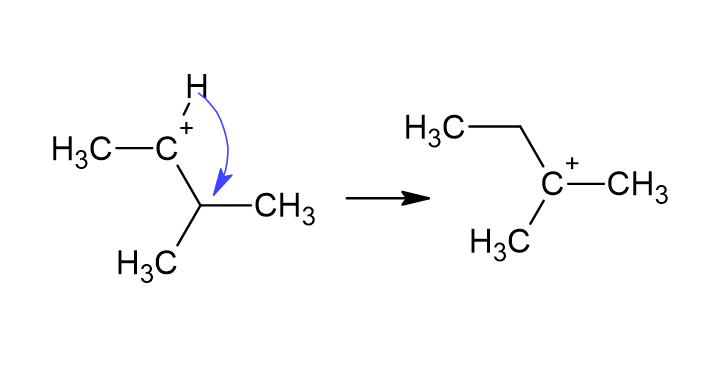
Правило Марковникова коротко: «Багатий воднем стає ще багатшим». Пояснення базується на стійкості карбокатіону: утворюється той карбокатіон-посередник, який є стабільнішим (третинний > вторинний > первинний).
Механізм реакції за правилом Марковникова
Розглянемо приклад приєднання HBr до пропену CH₃–CH=CH₂. Реакція проходить у два етапи:
- Протон H⁺ приєднується до менш заміщеного вуглецю (того, що має більше воднів). Утворюється вторинний карбокатіон CH₃–CH⁺–CH₃ (а не первинний CH₃–CH₂–CH₂⁺, бо він менш стабільний).
- Бромід-іон Br⁻ атакує позитивно заряджений вуглець, тому утворюється 2-бромпропан CH₃–CHBr–CH₃.
За правилом Марковникова основним продуктом завжди буде той, де галоген (або OH-група) стоїть при більш заміщеному вуглеці.
Найпоширеніші приклади застосування правила Марковникова
Ось кілька класичних реакцій 10 класу:
- CH₃–CH=CH₂ + HBr → CH₃–CHBr–CH₃ (2-бромпропан)
- CH₃–CH₂–CH=CH₂ + HI → CH₃–CH₂–CHI–CH₃ (2-йодбутан)
- (CH₃)₂C=CH₂ + H₂O (H⁺) → (CH₃)₂C(OH)–CH₃ (2-метилпропан-2-ол)
Типові реагенти, що підкоряються правилу Марковникова:
- HX (HCl, HBr, HI)
- H₂O у присутності H₂SO₄ або H₃PO₄
- ROH у кислому середовищі
- Hg(OAc)₂ / H₂O (оксимеркурування-демеркурування)
Винятки та анти-Марковниковське приєднання
Існують ситуації, коли продукт виходить протилежний очікуваному. Найвідоміший виняток — приєднання HBr у присутності перекисів (ефект Хараша). У цьому випадку утворюється радикальний механізм, і бром приєднується до менш заміщеного вуглецю.
Приклад:
CH₃–CH=CH₂ + HBr (перекиси) → CH₃–CH₂–CH₂Br (1-бромпропан)
Інші випадки анти-Марковникова:
Гідроборування-окислення (BH₃, потім H₂O₂/NaOH) — завжди дає анти-Марковников продукт (OH-група при менш заміщеному вуглеці). Приєднання HBr до алкінів у деяких умовах.
Порівняльна таблиця продуктів
| Алкен | Реагент | Продукт за Марковниковим | Продукт анти-Марковников |
|---|---|---|---|
| Пропен CH₃CH=CH₂ | HBr (без перекисів) | CH₃CHBrCH₃ | — |
| Пропен CH₃CH=CH₂ | HBr + перекиси | — | CH₃CH₂CH₂Br |
| Пропен CH₃CH=CH₂ | 1. BH₃ 2. H₂O₂/OH⁻ | — | CH₃CH₂CH₂OH |
| 2-метилпропен | H₂O / H⁺ | (CH₃)₂C(OH)CH₃ | — |
Чому правило Марковникова важливе для 10 класу
У шкільній програмі правило Марковникова допомагає не тільки правильно писати продукти реакцій, а й розуміти логіку органічної хімії: стійкість проміжних частинок визначає напрямок реакції. Знання винятків (особливо ефекту перекисів) часто зустрічається в тестових завданнях ЗНО та ДПА. Розуміння цього правила дає міцну базу для вивчення далі — реакцій алкінів, аренів, полімерізації та багатьох синтезів.
Правило Марковникова, попри свою простоту, залишається одним із фундаментальних інструментів органічної хімії. Воно дозволяє за лічені секунди визначити головний продукт реакції приєднання до несиметричних алкенів. Знання винятків робить вас не просто виконавцем, а тим, хто справді розуміє механізми реакцій. Опановуйте його — і задачі з органічної хімії стануть значно простішими!